主页 > 新闻中心 > 公司新闻 > 胚胎绒毛染色体检测在自然流产人群普及的必要性
胚胎绒毛染色体检测在自然流产人群普及的必要性

生殖分会场上,苏州市立医院生殖和遗传中心主任医生李红教授,提出了自然流产后应该进行流产物遗传学检测的普筛观点,并且分享了一些自然流产的临床案例来说明胚胎绒毛染色体检测的必要性。

自然流产是指妊娠不足28周、胎儿体重不足1000g的自然终止者。连续发生3次或3次以上的自然流产者称为复发性流产(RSA)。发生在12周以前的流产定义为早期流产,妊娠12周至不足28周的流产定义为晚期流产。80%以上的自然流产发生在妊娠12周以内,随后流产率迅速下降1。
在人类妊娠中,约70%以自然流产而告终,大部分胚胎在着床后很快就停止发育,仅表现为月经过多或月经延迟,因此通常不被人察觉。最终能活产的大概仅占人类妊娠的30%左右2。
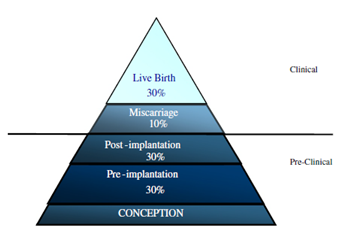
(图1:妊娠不同阶段流产的发生率)
自然流产的原因包括胚胎染色体异常、母体因素、免疫因素、内分泌因素、感染因素、环境因素等。据统计,约50-70%的自然流产是由胚胎染色体异常所致,并且自然流产发生越早,胚胎染色体异常的比例越高3。胚胎染色体异常的原因可分为遗传自父母的染色体异常和胚胎自发突变的染色体异常。
1. 遗传自父母的染色体异常:在普通人群中,染色体异常的比例约为0.2%;而在复发性流产夫妇中,染色体异常携带者约3-8%,常见的有染色体平衡易位、罗伯逊易位、倒位等1。由于这类父母染色体异常只是在染色体结构上发生了改变,但并没有染色体上遗传物质的增减,因此这类染色体异常携带者本人与常人一样,没有智力、外貌、神经系统等方面的差异。但这类染色体异常携带者的生殖细胞在减数分裂时可能由于染色体分离错误而形成不正常的配子,在与正常人生育时,导致受精卵的遗传物质出现了增减,如父母中一方是染色体平衡易位携带者,可导致胚胎染色体出现部分缺失和部分重复的情况同时存在。因此,胚胎无法正常发育,引起自然流产。
2. 胚胎自发突变的染色体异常:通常在配子形成或受精卵分裂的过程中发生,大多都是随机性的,并且以染色体三体居多,如16-三体、22-三体、13-三体等。其他的染色体异常类型为多倍体、X单体 、染色体臂及末端的缺失/重复、嵌合体、单亲二倍体等4。虽说胚胎染色体自发突变再发的概率不高,但有典型三体妊娠史者,其三体再发风险会升高,并且三体的发生率也随着母亲年龄的升高而升高。除母亲高龄因素外,叶酸代谢障碍、环境污染等都是高危因素。父亲的精子问题多为性染色体异常,造成胎儿X染色体数目异常,这也是流产的高发风险。
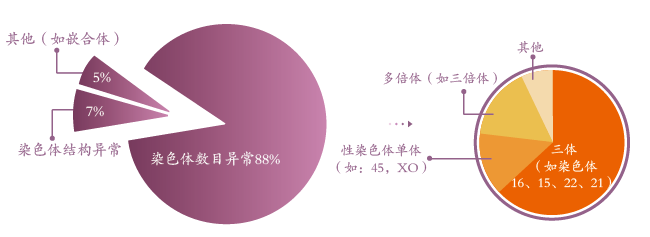
(图2:自然流产中染色体异常类型及比例)
李主任在会上强烈建议,流产后能取到胚胎绒毛的首选流产绒毛的染色体检测,理由有以下几点:
1. 因为只有这个检测才能帮助明确此次流产是否是胚胎染色体异常导致的。并且有时还可根据流产胚胎的染色体类型,及时发现父母的染色体问题,采取合适的生育方式,避免反复性流产的发生。随着婚龄以及孕龄的推迟,如果没有及时发现父母染色体问题,可能会因为多次流产错过合适的生育时机,给妇女及家庭造成巨大的精神压力。流产胚胎绒毛染色体检测结果可根据以下几种情况来推测是否是父母染色体异常导致的流产。
a. 胚胎染色体检测结果染色体部分缺失和部分重复情况同时存在,父母一方可能是平衡易位的携带者,父母需进行染色体核型分析,以明确胚胎染色体异常的来源。
有研究者对436例早期自然流产的样本用CGH和NGS的方法进行染色体拷贝数变异(CNVs)分析,检测出胚胎染色体异常的比例为51.6%,其中大多数染色体异常的类型为非整倍体。在436例流产物标本中,染色体片段缺失和片段重复同时存在共发现14例,在对其中12例流产胚胎的父母做核型分析后发现,有2对夫妇其中一方为染色体平衡易位携带者5。
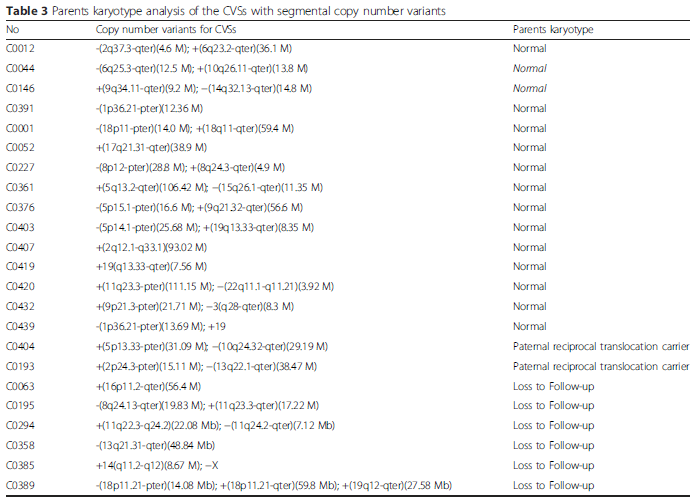
染色体平衡易位的患者可以通过自然试孕,结合产前诊断生育健康后代;据统计染色体平衡易位携带者自然试孕,其子代活产率为69%,其中26%同夫妇一样为平衡易位,仅13%流产儿为非整倍体异常,而18%胚胎染色体数目异常与父母染色体无关,包括三体和X性染色体单体,可能为自发突变引起的6。夫妇染色体结构异常虽对本身不造成表型异常,但可以对生育的子代染色体有影响,但这种影响并非绝对性,仍有可能生育正常子代。但患者夫妇可能要经历多次流产,从备孕到活产所需时间很难确定,反复自然流产造成的宫腔受损等身心伤害。为避免复发性流产,患者夫妇可采用第三代试管婴儿来获得健康宝宝。因此,临床可根据患者意愿给予合适的生育指导。
b. 流产物检测结果为近端着丝粒染色体(13、14、15、21和22号染色体)三体型及21号染色体单体型,父母可能是罗伯逊易位的携带者,父母也需进行染色体核型分析,以明确胚胎染色体异常的来源。以21三体为例,若夫妇染色体正常,通常这种情况是胚胎自发突变导致的,复发风险<1%,夫妇可尝试再次怀孕;若夫妇中一方为21、21同源罗伯逊易位,下次妊娠21三体复发风险100%,应劝其绝育;若夫妇中一方为21与其它近端着丝粒染色体(13、14、15、22号)非同源罗伯逊易位,则生育健康下一代的几率是1/6,可尝试通过第三代试管婴儿获得健康宝宝。否则自然试孕的流产风险太大。
c. 除了近端着丝粒染色体外的其他染色体三体型、染色体臂或末端的三体或单体、性染色体三体或单体、单亲二倍体,通常这类胚胎染色体异常是胚胎自发突变造成的,再次发生的几率并不高,夫妇只需调整心情,注意营养就可再次备孕。
2. 每次流产的检测结果可能为复发性流产的病因提供依据,如每次都是同一种染色体异常但父母血液核型正常,则父母需要再做一次生殖腺细胞的核型分析,以判断父母是否为生殖腺细胞的嵌合。
以嵌合型的21三体为例,这类患者有两个或两个以上的细胞系,它们是合子后有丝分裂不分离的结果。如果第一次卵裂时发生不分离,就会产生47,+21和45,-21两种细胞系。而后一种细胞是很难存活的。因此,导致嵌合体的不分离多半发生在以后的某次有丝分裂,而所有嵌合体内都有正常的细胞系。两个细胞系所占的比例在各组织中并不相同,通常异常细胞百分比在成纤维细胞中比在血细胞中高。有文献报道,一名患者血细胞中未发现三体细胞,而在成纤维细胞中却有17%为三体细胞,这说明三体细胞在各种组织中受到选择压力不同。嵌合体也可能是21三体的异常合子发生不分离的结果,即一个细胞株失去了一个21号,而返回正常,另一个细胞株仍为21三体。这也是为什么有时做外周血的核型分析结果是正常,而生殖腺细胞的核型分析为嵌合体的原因。
3. 如果每次流产的胚胎染色体异常并不是都一样,而是存在多个染色体问题,可查找夫妻双方是否存在减数分裂相关的基因突变。
异常染色体结构可能源自于可检测减数分裂异常的质量控制工厂的细胞检查机制缺陷。该检测机制,由蛋白质Mad1, Mad2, Bub1, Bub3, BubR1, 和 Mps1组成。最近的一项研究筛选了解决复制缺陷这个问题的两个候选基因,aurora kinase B(AURKB)和synaptonemal复合蛋白3(SYCP3)。在AURKB中,研究人员发现了低频非同义变异,包括多肽链中的改变p.A52V, p.I79T, 和p.A294T。另2个被研究的与流产相关的基因是BUB1和MAD2,在一个三体流产的研究中MAD2的作用被明确了。因此纺锤体中的异常会导致非整倍体,在严重的情况下会导致不育,比如最近发现的粘连蛋白STAG3突变会导致卵巢早衰7。
4. 根据检测结果,明确可能的病因,为下一次怀孕评估风险或对可能的孕妇身体问题及时排查并采取措施。
在排除胚胎染色体异常后,可对子宫、免疫、内分泌、感染、环境等做进一步的排查,查出问题后对症治疗。
5. 随着现代基因检测技术的进步,新技术、新方法层出不穷被逐渐应用于临床,检测费用也在不断降低,绝大部分普通家庭都可以承受。
基于以上这些原因,越来越多的专家认为自然流产后进行胚胎绒毛染色体分析对于临床是非常有必要的,流产胚胎绒毛的检测不仅能为临床评估孕妇下一次的流产风险,提供遗传建议及治疗方案,还能在一定程度上减轻流产孕妇紧张焦虑的情绪,有助于下一次的备孕。

天昊诊断目前有二款产品可对流产组织进行检测,分别是染色体非整倍体基因检测和染色体微缺失微重复突变检测。
 染色体非整倍体基因检测
染色体非整倍体基因检测共设计有170对探针,分布在24条染色体的着丝粒两侧及染色体末端约0Mb, 10Mb, 20Mb处进行探针设计,平均每条染色体覆盖5-8条。该体系可用于检测每条染色体靶定区域的拷贝数情况,以及染色体的末端缺失或重复。
 染色体微缺失微重复突变检测
染色体微缺失微重复突变检测共设计有1428对探针,覆盖了24条染色体的200个核心区域以及核心区域两侧一定范围区域、所有染色体着丝粒两侧和两端染色体离末端约0Mb, 10Mb, 20Mb处区域、以及3个突变位点(RBM8A :c.67+32G>C, c.-21delG; FGFR3:c.1138G>A),可对DECIPHER认定的70个综合征对应区域缺失重复或点突变位点,ISCA数据库中所有被至少4个先天系统性发育异常以及智力发育迟缓高风险CNV区段覆盖的区域的缺失重复,以及所有染色体非整倍体及染色体末端缺失重复进行检测。因此,该体系可用于检测每条染色体拷贝数情况,以及对染色体的微缺失微重复也能进行检测。

染色体核型分析是诊断染色体异常的金标准,它可以检测出染色体数目异常及大于5Mb的染色体结构异常,但这种技术必须要使用活细胞培养(由于流产组织通常胚胎已停止发育,因此存在无法培训的情况),操作繁琐,失败率高,并且耗时长(约2周左右);其他的检测技术如SNP芯片、aCGH、二代测序由于价格高昂,不适用于大规模推广,而像FISH、MLPA又由于通量太低,限制了该技术的应用,与这些技术相比,天昊诊断的染色体非整倍体基因检测和染色体微缺失微重复突变检测由于采用的都是高通量连接探针扩增技术(CNVplex®),具有通量高、检测速度快、准确度高及价格低等优势,一经上市就受到业界的广大好评。在上海国际妇女和平妇幼保健院发表的一篇关于CNVplex®用于流产物检测的文章中提到,CNVplex®对于流产物的检测结果与aCGH的结果完全一致,因此该技术可作为自然流产后有效的筛查方式8。

此外,该两种检测服务能同时对流产组织样本以及母亲基因组DNA进行个体鉴定(STR分析)可排除母血污染,大大提升了结果的准确性。个体鉴定还能对流产组织多倍体及单亲二倍体进行检测,丰富了染色体非整倍体基因检测及染色体微缺失微重复突变检测的检测内容。染色体微缺失微重复突变检测由于探针设计的密度高,因此检测的精细度要比染色体非整倍体好。病人可根据自己流产的次数及经济情况来决定选择哪种检测方式。
********************************************************************************************************
参考文献:
1. 中华医学会妇产科学分会产科学组. (2016). 复发性流产诊治的专家共识. 中华妇产科杂志 51卷第1期.
2. Elisabeth Clare Larsen et al., New insights into mechanisms behind miscarriage. BMC Medicine 2013, 11:154.
3. Warren, J.E., and Silver, R.M. (2008). Genetics of pregnancy loss. Clin Obstet Gynecol 51, 84-95.
4. van den Berg, M.M., van Maarle, M.C., van Wely, M., and Goddijn, M. (2012). Genetics of early miscarriage. Biochim Biophys Acta 1822, 1951-1959.
5. Jiandong Shen, Wei wu, Chao Gao, Humphrey Ochin, Dianyun Qu, Jiazi Xie, Li Gao, Yadong Zhou, Yugui Cui and Jiayin Liu . Chromosomal copy number analysis on chorionic villus samples from early spontaneous miscarriages by high throughput genetic technology. Molecular cytogenetics (2016) 9:7.
6. Carp H, Guetta E, Dorf H, et al. Embryonic karyotype in recurrent miscarriage with parental karyotypic aberration [J]. Fertil Steril, 2006,85(2):446-450.
7. Vaiman D. Genetic regulation of recurrent spontaneous abortion in humans[J]. Biomed J, 2014.
8. Songchang Chen et al., A copy number variation genotyping method for aneuploidy detection in spontaneous abortion specimens. Prenatal Diagnosis 2017,37,176-183.
1. 中华医学会妇产科学分会产科学组. (2016). 复发性流产诊治的专家共识. 中华妇产科杂志 51卷第1期.
2. Elisabeth Clare Larsen et al., New insights into mechanisms behind miscarriage. BMC Medicine 2013, 11:154.
3. Warren, J.E., and Silver, R.M. (2008). Genetics of pregnancy loss. Clin Obstet Gynecol 51, 84-95.
4. van den Berg, M.M., van Maarle, M.C., van Wely, M., and Goddijn, M. (2012). Genetics of early miscarriage. Biochim Biophys Acta 1822, 1951-1959.
5. Jiandong Shen, Wei wu, Chao Gao, Humphrey Ochin, Dianyun Qu, Jiazi Xie, Li Gao, Yadong Zhou, Yugui Cui and Jiayin Liu . Chromosomal copy number analysis on chorionic villus samples from early spontaneous miscarriages by high throughput genetic technology. Molecular cytogenetics (2016) 9:7.
6. Carp H, Guetta E, Dorf H, et al. Embryonic karyotype in recurrent miscarriage with parental karyotypic aberration [J]. Fertil Steril, 2006,85(2):446-450.
7. Vaiman D. Genetic regulation of recurrent spontaneous abortion in humans[J]. Biomed J, 2014.
8. Songchang Chen et al., A copy number variation genotyping method for aneuploidy detection in spontaneous abortion specimens. Prenatal Diagnosis 2017,37,176-183.